RT-PCR中模板的选择
在RT-PCR 实验中,选择总RNA或纯化的mRNA作为模板进行逆转录十分重要。mRNA虽然能提供略高的灵敏度,但总RNA经常使用,具有较mRNA更重要的优势。第一,其过程需要较少的纯化流程,这保证了更好的回收模板和更好的把结果标准化为起始的细胞数。第二,避免mRNA富集步骤,为了避免不同mRNA的回收率而带来结果偏移的可能性。总之,在大多数的应用中,目标基因的相对定量比检测的绝对灵敏度更重要,因此在多数情况下,总RNA更适用。
反转录酶的选择
反转录酶(Reverse transcriptase)又称逆转录酶。是以RNA为模板指导dNTP合成互补DNA(cDNA)的酶。一部分反转录酶具有RNA酶活性,能够在转录后降解RNA-DNA杂交链中的RNA链。如果反转录酶没有Rnase酶活性,可加入RNaseH来获得更高的qPCR效率。常用的酶包括Money鼠白血病病毒(MMLV)反转录酶和禽成髓细胞瘤病毒(AMV)反转录酶。依据RT-PCR,理想的状态下是选择具有较高热稳定性的反转录酶,cDNA的合成才能在较高的温度下进行,确保成功转录具有较高二级结构的RNA,并确保在整个反应过程中的全部活性,从而得到质量更高的cDNA。
RT-PCR引物的选择
逆转录引物一般包含3种:oligo dT引物,随机引物和特异性引物。对于短的且不具备发卡结构的真核细胞mRNA,三种都可用。
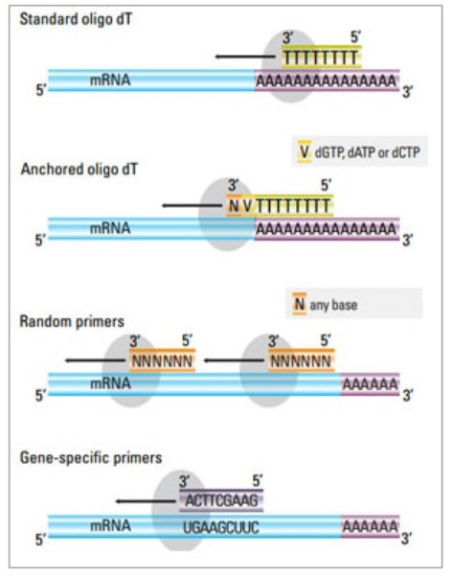

RT-PCR引物设计原则
1. 上下游引物要保守:扩增子长度需选择一段保守片段(100-200 bp)进行PCR扩增,选择片段需跨越内含子,因内含子的基因组DNA序列不会被扩增,也可减少从污染的基因组DNA中扩增得到的假阳性风险。引物选取同样需要保守。
2. 引物长度和Tm值:引物设计长度为18-25 bp,Tm值在50-65℃之间,引物中GC含量在40-60%。设计引物时尽量避免出现4个或超过4个G碱基。
RT-PCR实验阴性对照
反转录阴性对照应包括在所有的RT-PCR的实验中,用来检测DNA是否污染(如基因组DNA或PCR产物)。该对照所指不加反转录酶,通过反转录过程得到cDNA在进行荧光定量PCR检测。如检测到扩增,则样本中可能含有基因组DNA污染。